尽管是应急性的疫苗研发,但安全和有效仍然是最重要的。在疫苗研发上如果以牺牲安全和有效来换取速度,只能得不偿失。
这是疫苗研发史上从未有过的速度,也是一场史无前例的疫苗研发竞赛。
新冠肺炎疫情仍在全世界蔓延,率先初步控制疫情的中国,正在有序复工复产。无论是疫情焦灼的国家还是中国,所有人都期盼着特效药和疫苗的出现,因为只有特效药和疫苗才是最终阻断传染病发展的武器。特别是疫苗,让人们翘首以盼。
迄今,中国、美国、德国、英国、法国、日本、以色列、新加坡、澳大利亚、印度等国的新冠肺炎疫苗研究都表现出不俗的实力,所有的进度以小时计。
参与新冠肺炎疫苗研发的,不仅有像辉瑞这样的制药巨头,有中国实力雄厚的科研机构,也有规模并不算大的新锐药物研发公司。总之,英雄不问出处,全世界在同一条起跑线上争分夺秒。
过去,中国几乎没有自己的原研疫苗,近年来疫苗研发能力逐渐提升。而发生在2018年的长春长生疫苗事件,曾严重打击人们对国产疫苗的信任感,使得国内疫苗产业的信誉受到严重影响。新冠肺炎疫苗的研发,让中国疫苗研发站上一条全新的起跑线。
尽管是应急性的疫苗研发,但安全和有效仍然是最重要的。在疫苗研发上如果以牺牲安全和有效来换取速度,只能得不偿失。
 2 月 25 日,工作人员在中国疾病预防控制中心传染病预防控制所 P3 实验室传递窗口接收刚刚从浙江省疾控中心运抵的疫苗生产用新型冠状病毒毒株。
2 月 25 日,工作人员在中国疾病预防控制中心传染病预防控制所 P3 实验室传递窗口接收刚刚从浙江省疾控中心运抵的疫苗生产用新型冠状病毒毒株。这些疫苗跑到前面
“我们正在一边飞行一边造飞机。”美国梅奥诊所疫苗研究部主任、《疫苗》周刊主编格雷戈里·波伦对新冠肺炎疫苗研发现状的形容特别贴切。
世界各国的科研机构选择不同的“土壤”、不同的“路径”、从多个方向研发新冠肺炎疫苗。美国生物科技公司莫德纳(Moderna Inc。)研发的 mRNA 疫苗,中国康希诺生物的Ad5-nCoV,美国Inovio公司的INO-4800,国药集团中国生物武汉生物制品研究所的新型冠状病毒灭活疫苗,北京科兴中维生物技术有限公司研制的新型冠状病毒灭活疫苗……在全球一百多项在研的疫苗开发项目中,上面这些是进度最快的。
4月12日,一对武汉的中年夫妻,胳膊上种下一针试验阶段的新冠肺炎疫苗。这一天,距离中国向世界卫生组织(WHO)提交新冠病毒基因组序列信息、开放给全球共享,正好是三个月的时间。
 2 月 11 日,在瑞士日内瓦,世界卫生组织总干事谭德塞(右二)在新闻发布会上发言。谭德塞当日表示,新 型冠状病毒疫苗有望在 18 个月内准备就绪。
2 月 11 日,在瑞士日内瓦,世界卫生组织总干事谭德塞(右二)在新闻发布会上发言。谭德塞当日表示,新 型冠状病毒疫苗有望在 18 个月内准备就绪。他们的女儿、29岁的武汉人吴妮,也是新冠疫苗临床试验高剂量组的志愿者,她已经结束了为期14天的隔离观察。吴妮一直鼓励父母报名参加疫苗II期临床试验。这一款疫苗I期临床试验的启动时间,距离公开病毒基因序列信息不过2个月。
他们参与的临床试验是重组新型冠状病毒(2019-COV)疫苗(腺病毒载体)的 II期临床试验,由中国工程院院士、军事医学研究院研究员陈薇团队领衔,是全球一百多项疫苗研发项目中,第一个进入II期临床试验阶段的疫苗,是进展速度最快的项目之一。
很多普通人参与了历史。
高校教师大白(化名)出门参加临床试验之前,希望让一年级的儿子理解他的决定。儿子是个航天迷,大白对儿子说:爸爸这个就像登月一样,爸爸的一小步,是人类的一大步。
新消息接踵而至。4月13日,国药集团中国生物武汉生物制品研究所申报的一类新药——新型冠状病毒灭活疫苗,已获得国家药品监督管理局临床试验许可。这是全球首家获得临床试验批件的新冠病毒灭活疫苗。
同一天,国家药品监督管理局批准科兴控股生物技术有限公司旗下北京科兴中维生物技术有限公司研制的新型冠状病毒灭活疫苗(品牌名:克尔来福)进入临床研究。资料显示,2020年1月3日,科兴中维与中国疾病预防控制中心等单位沟通信息并提供病毒培养用细胞等;1月28日,科兴中维正式立项启动新冠灭活疫苗研制项目。
美国Moderna公司的mRNA-1273,也是世界上最早进入临床试验的疫苗,有很强的竞争力。这款疫苗启动临床试验的时间与陈薇团队的时间几乎同时。
据美国媒体报道,美国国立卫生研究院(NIH)为这项试验提供资金,疫苗由NIH和Moderna公司联合开发。试验将在西雅图的凯撒华州卫生健康研究所 (KPWHRI)进行。Moderna公司曾在2018年创下美国最大生物医疗公司 IPO 纪录,是全球mRNA巨头之一。该公司于2010年由哈佛团队创办,比尔盖茨夫妇的基金会也是股东之一。
除了以上三种疫苗,目前还有几种疫苗进展速度很快,包括美国Inovio公司的INO-4800,深圳市免疫基因治疗研究院(Shenzhen Geno-Immune Medical Institute)的LV-SMENP-DC和具病原特异性的aAPC等。
至此,全球 5 款进入人体临床试验阶段的新冠病毒疫苗中,中国占 3 款。另外两款是美国生物科技公司莫德纳(Moderna Inc。)研发的 mRNA 疫苗,以及伊诺维(Inovio Pharmaceuticals Inc。)研发的新冠 DNA 候选疫苗。
何时能用上新冠疫苗?
各国基本上都采用了多线并行的方法,用多种技术开发新冠肺炎疫苗。
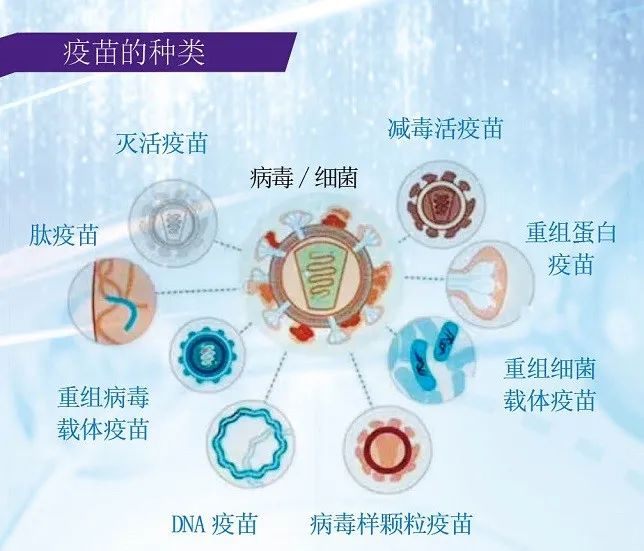
据介绍,国务院联防联控机制科研攻关组专门设立疫苗研发专班,按照灭活疫苗、重组蛋白疫苗、腺病毒载体疫苗、减毒流感病毒载体活疫苗、核酸疫苗5条技术路线共布局12项研发任务,目前均在稳步推进。
中国工程院院士王军志在近期的新闻发布会上介绍说,我们国家在制备灭活疫苗方面基础比较好,此前研发出甲型H1N1流感灭活疫苗、甲型肝炎灭活疫苗、EV71手足口病灭活疫苗以及Sabin株IPV脊灰疫苗。
所有人都希望新冠肺炎疫苗能早点研发出来并让大家接种上,但疫苗研发的复杂,决定了研发过程无论如何压缩都需要一定的时间。
首先,疫苗是给健康人接种的,因此对它的安全性要求比药物还要高,必须要经过三期临床试验验证安全性后才能获批。其次,疫苗生产工艺复杂,就算获批,也不可能像口罩一样即刻大量上市。
过去,一种新疫苗的研发时间平均在10年,迄今研发速度最快的记录,是埃博拉疫苗。
2013年埃博拉疫情在西非大规模暴发,疫苗的研发正式开始,2017年疫苗上市,整个过程用了5年。但和新冠肺炎疫情不同的是,2013年并非人类第一次认识埃博拉病毒,埃博拉疫情此前已经零星暴发多年,科学家对埃博拉病毒的研究已经有了基础。
钟南山院士4月12日接受媒体采访时表示:真正终结疫情,疫苗挺重要的,现在各国都在以最快的速度研发。但我不认为疫苗三四个月时间就能做出来。此外,根据抗击“非典”的经验,去掉中间宿主,也能阻断疫情的传播。目前,我们还不知道新冠病毒的传播链是怎么样的,搞清楚之后切断也很重要。把全部希望放在疫苗上,其他方法一概不管,是消极的。而且疫苗出来后,也不可能一下就非常完善,易感人群可打,但没必要全部人群人人都打。
 1 月 29 日,上海某实验室中工作人员在演示新型冠状病毒 mRNA 疫苗实验过程。
1 月 29 日,上海某实验室中工作人员在演示新型冠状病毒 mRNA 疫苗实验过程。国务院联防联控机制4月14日在北京召开的新闻发布会上,科技部社会发展科技司司长吴远彬强调:“我们本着科学、安全、有效的基本前提,因为这是给健康人使用的特殊产品,所以疫苗研发的过程中,尽管是应急项目,但还是特别强调科学性、程序性。”
王军志院士介绍说,疫苗是应用于健康人的特殊产品,我国新冠肺炎疫苗在应急审批过程中始终尊重科学、遵循规律、以安全有效为根本方针,坚持特事特办。“在这个过程中很多研发的步骤由串联改为并联、研审联动、滚动提交研发材料、随交随审随评,在标准不降低的前提下,通过无缝衔接,大大提高了研发的效率和审评的效率。”
安全和有效是第一位
全球疫苗竞争中,安全和有效才是核心竞争力,现在是这样,过去也是这样。
现代医学意义上的疫苗诞生在西方。从英国乡村医生爱德华-琴纳用牛痘预防天花、法国医学家路易·巴斯德发明狂犬病疫苗,到如今几家跨国药企依然保持新疫苗研发主动权,疫苗研发在过去100年中一直是西方企业和科学家的天下。
就是在新冠肺炎疫苗研发中,北美国家依旧体现出巨大的优势。从所有疫苗研发项目的地区分布看,大多数新冠肺炎疫苗的开发商来自北美。据媒体统计,已确认的78个处于活跃状态的候选疫苗研究项目中,有36家在北美,占46%;而中国、亚洲(中国除外)和澳大利亚,以及欧洲各有14家,占18%。
改革开放后,海外制药企业生产的疫苗进入中国,中国人开始获得同等品质的疫苗。一些制药巨头不仅将产品带到中国市场,还将制造环节放在中国。
中国管理部门把疫苗分为“免疫规划类疫苗”和“非免疫规划类疫苗”,后者并非不重要,而是考虑到国家财政支出压力,需要由个人支付接种的疫苗。在接种“非免疫规划类疫苗”时,很多中国家长会更倾向于进口疫苗,因为家长们会从历史发展和企业信誉、实力等方面综合考虑。特别是一些技术难度比较大的疫苗,进口疫苗的竞争优势至今还是很明显的。
在疫苗这个特殊产品的选择上,特别是给婴幼儿注射的疫苗,家长们更加关注安全性和有效性。
长春长生疫苗事件曾经给中国的家长们带来很大的心理阴影。2018年7月15日,国家药品监督管理局发布通告称,国家药监局在对长春长生生物科技有限责任公司开展飞行检查中,发现该企业冻干人用狂犬病疫苗生产存在记录造假等严重违反《药品生产质量管理规范》行为,对此责令吉林食药监局收回该企业《药品GMP证书》,并责令狂犬疫苗停产。那段时间,很多家长不敢给孩子接种疫苗,导致很多孩子没能按时完成疫苗接种。
为什么一种新疫苗的研发需要起码长达十年、投入巨额资金、每一步都不能错?因为疫苗是研发难度最大、生产工艺复杂,又事关健康人安全的特殊产品。技术上和投入上的高门槛,使得世界上很多真正称得上“明星疫苗”的疫苗产品,很难被模仿和超越,成为某种疾病领域的“独一份”。
在肺炎球菌疫苗领域,肺炎球菌多糖结合疫苗就是一个重大的突破,而开发这一技术和产品的辉瑞公司,则统领这一领域20年。曾经,另一家跨国药企试图研发类似产品,最终以失败告终。
肺炎球菌多糖结合疫苗出现之前,已有的肺炎球菌疫苗在预防机制上存在缺陷,特别是在儿童的免疫应答上,不能获得很好的效果,幼儿接种后效果不理想,但幼儿又是受肺炎球菌感染影像最严重的群体。为了解决这一缺陷,世界上各大实力雄厚的医药企业展开了竞赛。
2000年,辉瑞公司研发的7价肺炎球菌多糖结合疫苗在这场竞赛中先胜一程,2000年在美国获得FDA批准上市,成为当时唯一可以为5岁以下儿童接种的肺炎球菌疫苗。2010年,7价肺炎球菌多糖结合疫苗的“升级版”—— 13价肺炎球菌多糖结合疫苗在美国获批上市。
从世界上首个13价肺炎球菌多糖结合疫苗上市至今,辉瑞公司已经向全球165个国家销售超过14亿支疫苗,全球每年接种量超过1.5亿剂次,有效性和安全性得到广泛证实,迄今未出现过大规模的不良反应和召回事件。
13价肺炎球菌多糖结合疫苗的故事告诉我们,疫苗的研发和生产成本巨大,而一旦一种疫苗产品在安全性和有效性上取得突破,那么它也会成为信誉最好、最受信任的产品,并且让其他竞争者难以真正达到类似的产品品质。
今年,一款国产13价肺炎球菌多糖结合疫苗获批上市,但业内专家表示,这款疫苗与辉瑞公司10年前就在美国获批上市的疫苗相比,还是存在一些差距。
首先从研发标准上,国内这款13价肺炎球菌多糖结合疫苗对标的是辉瑞公司的7价肺炎球菌多糖结合疫苗。疫苗中所谓的“价”是指病毒血清型,一种疫苗要扩展覆盖病毒血清型的种类,中间是存在技术难度的。印度是仿制药大国,曾经有一家印度的仿制药公司试图仿制辉瑞的13价肺炎球菌多糖结合疫苗,但最终因无法克服技术难题而放弃。
其次,两种疫苗所利用的载体蛋白不同,这就好比种花用的土壤不一样,关系到疫苗的安全性和有效性。
第三,疫苗的储存条件和保质期是产品稳定性的体现,越是严苛的储存条件和保质期限制,说明产品在稳定性上没有那么“自信”。国产13价肺炎球菌多糖结合疫苗在储存条件和保质期上都比进口产品更局限。
第四,中国对进口疫苗实行严格的检查制度。进口的13价肺炎球菌多糖结合疫苗接受“全检”,每一个批次都检测,且所有的检测项目都检测;而国产产品实行“抽检”,不要求每批检测,也不要求所有的项目都检测。
研发环节、制造环节的种种技术壁垒,导致世界上应用最广泛的几款原研“明星疫苗”,都是为数不多的几家制药巨头企业的产品,这些企业掌握了疫苗研发和生产的关键技术,让模仿者难以效仿。
从这些经典的疫苗诞生故事中可以看出,疫苗研发和生产,必须保持谨慎态度。尽管为了控制新冠肺炎疫情的蔓延需要加速疫苗研发,但疫苗是一种非常特殊的生物制品,越是急于成功之时,越要冷静和理性,研发机构必须为普通人的健康和安全负起责任。
有竞争也有合作
新冠肺炎疫情波及的范围、带来的损失史无前例,很多人甚至将新冠肺炎疫情与1918年大流感进行对比。
时代的进步对于传染病来说是硬币的两面。由于交通发展、人员世界性流动,新冠肺炎病毒得以更快地在世界各地传染。但好的一面是,医学已经不是一百年前的样子,生物技术、疫苗的研发流程在过去一百年中改天换地,科研合作、商业合作的方式也与一百年前完全不同。
新冠肺炎病毒被发现不久,中国就向全世界公布了病毒的基因信息,这是疫苗研发的基础,也称得上是最重要的全球合作举动。
目前,全球也已经启动多个强强合作的新冠肺炎疫苗研发项目。
4月9日,辉瑞公司在官网公布了抗击新冠病毒斗争中取得的最新进展。在疫苗研发方面,辉瑞公司与BioNTech SE签署了一项全球合作协议,以根据基于mRNA的新冠病毒疫苗计划共同研发BioNTech公司预防新冠病毒感染的潜在疫苗。

辉瑞公司宣布正在与一家德国企业共同研发新冠肺炎疫苗。
这两家公司于 2020年3月公布了合作意向书,两家公司最初在美国和欧洲的多个研究基地就新冠病毒候选疫苗联合开展临床试验。一旦获得监管部门的批准,BioNTech和辉瑞计划最早于2020年4月底开始临床试验。辉瑞公司透露,如果此项研发计划取得技术成功并获得监管机构的批准,到2020年底前有望供应数百万剂疫苗,并且在2021年迅速扩大到数亿剂的产能。
辉瑞首席科学家兼全球研发及医学总裁Mikael Dolsten指出:“抗击此次新冠病毒疫情,需要在整个创新生态系统中进行空前的合作,各公司必须以前所未有的方式团结合作。我为辉瑞与BioNTech的合作感到自豪,并对我们以科学的力量、尽快共同研发出全球亟需的潜在疫苗的能力充满信心。”
新冠肺炎疫情发生后,辉瑞董事长兼 CEO艾伯乐博士向媒体公开五项承诺,呼吁生物制药行业通过空前的协同合作共同抗击新冠肺炎。
1。辉瑞承诺在一个开放的资源平台上向广泛的科研团体共享一些现有的重要工具,并实时分享从其他公司获得的数据和知识,从而加快为病人提供药物和疫苗。
2。辉瑞已组建一支专项研究特别行动小组,汇集了卓越的病毒学家、生物学家、化学家、临床医生、流行病学家、疫苗专家、制药科学家和其他重要专家,集中精力应对这次疫情。这支团队正专注于加快科研与开发进程,力争尽快向患者提供亟需的药物和疫苗。
3。辉瑞承诺分享在临床研发和监管方面的经验,为这些公司提出的、最具前景的候选药物提供支持。
4。作为疫苗和药物的最大生产商之一,辉瑞承诺利用各种过剩的产能,并有可能转变生产配置,切实支持其他公司尽快实现可拯救千百万生命的重大医学突破,尽快造福于广大患者。
5。辉瑞正在联络一些联邦机构,包括国家卫生研究院(NIH)、国立过敏和传染病研究院(NIAID)和疾控中心(CDC),组建一支由科学家、临床医生和技术人员组成的跨行业快速响应团队,一旦今后出现疫情就可立即采取行动。
新冠肺炎疫苗的研发,可能会将世界疫苗竞争带入新的时代,在这个新时代中,合作与竞争共存、新的技术和机制涌现。未来,疫苗研发不能再“从前慢”,快速研发安全有效的疫苗,才能应对来势汹汹的新型传染病,而要实现“又快又好”,恐怕更要依靠实力雄厚的企业与研究机构合作携手。




